Tipos de reacciones químicas
1. reacción de combinación (síntesis)
A + Z ----------------------
AZ
2. reacción de descomposición
AZ --------------------------
A + Z
3. Reacción de desplazamiento
A + BZ -------------------
AZ + B
4. Reacción de doble desplazamiento
AX + BZ----------------
AZ + BX
Reacción de combinación síntesis: consiste en la unión de
dos o más sustancias sencillas para tomar una más compleja.
Reactivos producto
Reacción de análisis: este tipo de reacción es inversa a
la de la síntesis: una sustancia compleja, mediante energía se divide en dos o
más sustancias
CaCO3 ---------------------------------------- CaO + CO2
Reacción por sustitución simple o desplazamiento
Es aquella reacción en la que los átomos de un elemento
desplazan en un compuesto a los átomos de otro elemento .este desplazamiento
sucede siempre y cuando el átomo sustituyente tenga mayor actividad que el
sustituido.
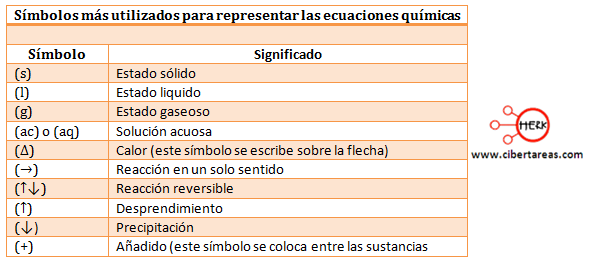
CONDICION DE UNA ECUACION QUIMICA CORRECTA
Los símbolos y las fórmulas de reactantes y productos
deben estar correctamente escritas.
Deben aparecer moléculas de los elementos y no átomos
libres
BALANCE DE ECUACIONES CORRECTAMENTE POR ESTE METODOD SE
SIGUEN LOS SIG. PASOS
Nota: los subíndices de las formulas no pueden alterase
1. Seleccionar un compuesto que contenga el átomo de un elemento que se repita en la mayoría
2. Asignar a la fórmula del compuesto un coeficiente que
logre igualar el número de átomos en reactantes y productos
En una reacción no se crean ni se destruyen átomos:
números de cada elemento a cada lado de la flecha, tienen que ser iguales. Si
se satisfacen esta condición se dice que esta ecuación está ajustada.
Balanceo de ecuaciones
Nunca deben modificarse los subíndices al ajustar una
reacción.
CH4 + 2 O2
CO2
+ 2H2O
Se ajustan los elementos que están en cada
molécula en cada miembro de la reacción.
EJEMPLOS
DE BALANCEOS
1. 2Fe + HCl ----------
2FeCl3 + 3H2
T.R:simple
desplazamiento 2-Fe-2
6-1-H-1-6
6-1-Cl-6
2Fe + 6HCl -------------2FeCl3 + 3H2
2.2HCl
+
Ca (OH)2 ------------- CaCl + 2H2O
Hidrogeno, cloro, calcio,
oxigeno
4-H-4
2 - Cl-2
1-Ca-1
2-O-2
3. P+ O2 -----------
P2 O3
FOSFORO,
OXIGENO. T.R COMBINACION
4-1-P-2-4
6-2-O-3-6
RESPUESTA: 4P+ 3 O2---- -----2P2 O
4.
P2O5 + H2O
H3PO4
FOSFORO, OXIGENO E HIDROGENO T.P: COMBINACION
4-2-P-1-4
16-6-O-4-16
12 -2-H-3-12
RESPUESTA: 2P2O5 + 6 H2O ----------------------